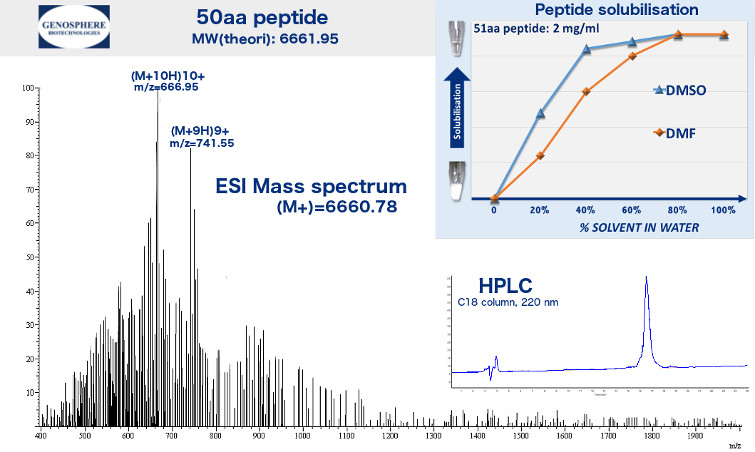
Nous préparons des peptides totalement caractérisés pour la recherche. Les quantités vont de quelques mg à plusieurs centaines de gramme. La plupart des synthèses sont réalisées en phase solide avec la chimie Fmoc mais une synthèse en phase liquide peut être utilisée lorsque la structure ou la séquence du peptide l’impose. Les peptides sont ensuite purifiés à différents niveaux de pureté par HPLC en phase inverse. Nous nous tenons à votre disposition pour vous conseiller sur le niveau de pureté optimum adapté à vos applications.
Nos peptides sont destinés uniquement à la recherche in vitro et ne peuvent pas être utilisés pour des applications médicales ou diagnostiques.
1- Gammes de synthèse standard
Les gammes de synthèse les plus fréquemment demandées sont présentées dans le tableau ci-dessous. Mais nous préparons couramment des quantités plus importantes et des peptides plus longs. Merci de nous contacter avec votre/vos séquence(s), la quantité et le niveau de pureté que vous souhaitez, nous ne manquerons de vous répondre et de faire une proposition intéressante.
- Délais rapides
- Taux de réussite des synthèses +97 %
- Qualité garantie
| Groupes de tarifs(I-VI) en fonction de l'échelle de synthèse (mg) | (I) (II) (III) (IV) (V) (VI) |
2 mg (quantité minimale) 5 mg à 30 mg par incrément de 5 mg 30 mg à 100 mg par incrément de 10 mg 0,1 g à 1 g par incrément de 50 mg 1 g à 10 g par incrément de 500 mg >10 g |
| Niveaux de pureté: | >70%, >80%, >90%, >95% et >99% |
| Données analytiques: | Chromatogramme HPLC (220 nm), Spectre de masse (MALDI-TOF, EI), test de solubilité |
| Longueur de chaîne: | Standard:5-30 aa ; Routine: 31-60 aa ; Longueur maximale: environ 100 aa |
| Structure : | Extrémités libres (i.e. NH2- and-COOH ) |
| Contre-ion: | Standard: Trifluoroacétate (tfa); Option: Acétate ou chlorure |
| Forme: | Lyophilisat |
2- Purification par HPLC en phase inverse
Les niveaux de pureté garantis obtenus par HPLC sont : >70%, >80%, >90%, >95% et un niveau unique ultra-pur >99%.
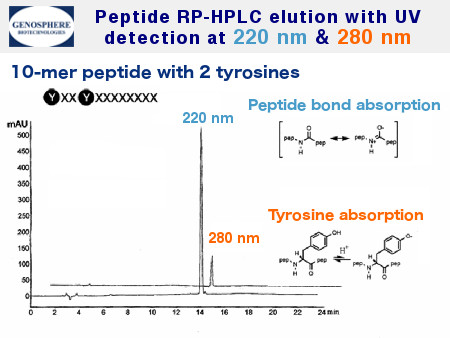
La purification est réalisée par HPLC en phase inverse préparative ou semi-préparative. Généralement, des colonnes C8 ou C18 sont utilisées et l’élution est effectuée par des gradients linéaires d’acétonitrile en solution aqueuse à 0,1% de tfa et suivie par UV à 220 nm.
Le suivi de l’élution peut se faire à une plus grande longueur d’onde (typiquement 280 nm) pour des peptides contenant des acides aminés aromatiques (figure 2).
Le peptide de synthèse brut contient des sous-produits provenant des cycles de couplage avortés (i.e. des chaînes tronquées), et ensuite de l’oxydation, modification, ou hydrolyse des chaînes latérales survenant lors du clivage et de la déprotection. Les quantités d’impuretés dépendent de la longueur du peptide et de sa séquence.
Nous sommes à votre disposition pour vous conseiller un niveau de pureté adapté à votre propre application conformément aux grandes lignes ci-après.
Applications expérimentales et niveaux de pureté recommandés
Pureté >70%
Criblage large spectre de peptides ; production d’anticorps polyclonaux ; criblage préliminaire de bibliothèques ; un niveau de pureté plus élevé est normalement préférable pour des peptides de plus de 20aa.
Pureté >80%
Essais de dépistage biochimique ; tests immunologiques qualitatifs (ELISA, compétition, déplétion…) ; production d’anticorps polyclonaux avec des peptides longs.
Pureté >90%
Tests biologiques préliminaires de peptides candidats ; production d’anticorps polyclonaux mono-spécifiques ; fabrication de colonnes d’affinité ; études structure-activité ; tests biochimiques qualitatifs (activité enzymatique, spécificité…).
Pureté >95%
Essais immunologiques quantitatifs (ELISA, compétition, déplétion…) ; essais biochimiques quantitatifs (activité enzymatique, cinétique…) ; généralement recommandée pour des peptides modifiés ; analyse structurelle préliminaire (RMN,…).
Pureté >99%, ultra-pur
Essais en culture cellulaire ; bio-essais quantitatifs, études structurelles (Crystallographie, RMN…).
3- Les extrémités des peptides
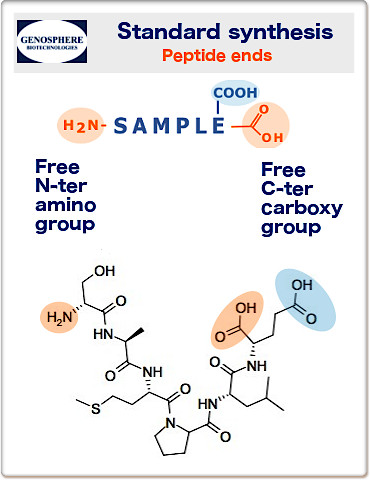
L’extrémité N-terminale est l’extrémité d’un peptide qui possède un groupe amine libre (-NH2), tandis que l’extrémité C-terminale est l’extrémité qui possède un groupe carboxyle libre (-COOH). Lors de la conception d’un peptide, il faut se demander quelles extrémités conviendraient le mieux à l’application concernée. En fonction des exigences, le cas échéant, en matière de charge globale du peptide ou de stabilité vis-à-vis des activités des exopeptidases, on peut envisager un blocage des extrémités N- et/ou C.
• Synthèse peptidique standard: Extrémités non-bloquées
Nos peptides sont normalement synthétisés avec des extrémités non bloquées:
Extrémité N-terminale: amine (H2N-) et extrémité C-terminale: carboxyle (-COOH).
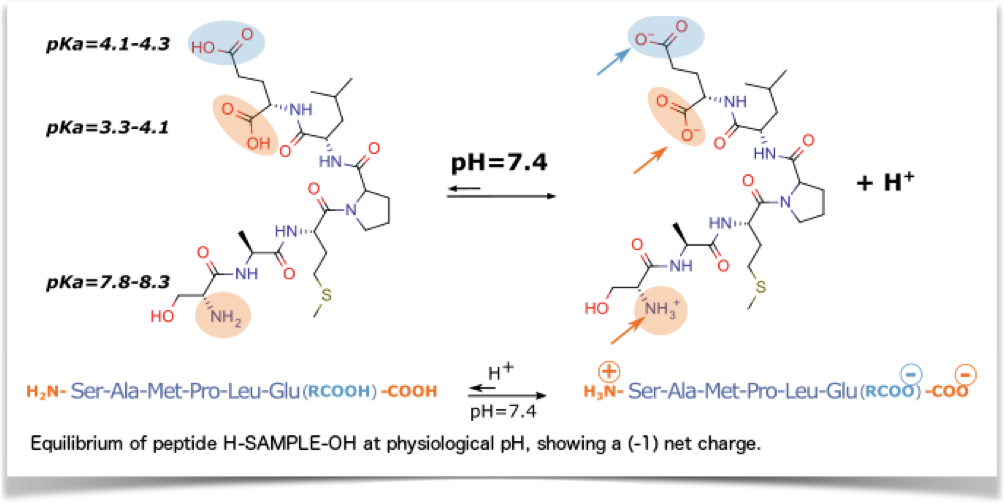
Les valeurs de pKa du groupe alpha-amine et du groupe acide carboxylique indiquent que les extrémités des peptides sont généralement chargées électriquement à pH physiologique.
• Blocage et protection des extrémités
Dans certains cas, il peut être préférable de neutraliser ces charges électriques en utilisant des groupes “blocage”. À cet effet, les extrémités peptidiques sont souvent modifiées par :
une acétylation N-terminale et/ou une amidation C-terminale.
Les peptides comportant des groupements N-acétyle et le C-amide mimiquent ainsi les séquences internes car ils ont des extrémités non chargées. De plus, ces groupes bloquants améliorent la résistance à la dégradation enzymatique. Il convient de noter que, comme cela peut être anticipé, cette neutralisation de(s) charge(s) entraîne aussi souvent une diminution de la solubilité.
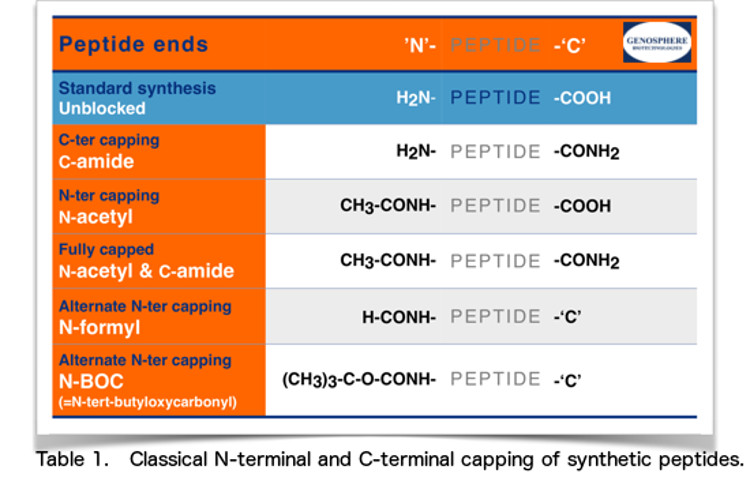
Dans d’autres cas, il peut être souhaitable de modifier l’extrémité N- ou C-terminale de manière à empêcher ou à réduire l’hydrolyse enzymatique, notamment lorsque les peptides sont destinés à être utilisés dans des systèmes biologiques où une activité enzymatique est présente, par exemple les fluides corporels ou cellulaires, les bactéries, etc.
Les peptidases peuvent être regroupées en fonction du schéma de protéolyse en endo- ou exo-peptidases. Les exopeptidases catalysent l’élimination des acides aminés (ou des peptides courts) à l’extrémité d’une chaîne polypeptidique par l’hydrolyse des liaisons peptidiques.
Ces enzymes sont largement répandues dans la nature et peuvent être divisées en sous-groupes. Plus précisément, les aminopeptidases hydrolysent les acides aminés de l’extrémité N-terminale d’un peptide, tandis que les carboxypeptidases hydrolysent les acides aminés de l’extrémité C-terminale.
Là encore, N-acétylation et C-amidation sont couramment utilisées pour protéger les extrémités du peptide de l’hydrolyse des exopeptidases.
D’autres modifications N-terminales, notamment la N-pyroglutamylation, la lipidation, la cyclisation et la PEGylation, ont permis d’accroître la biostabilité des peptides.

4- Contre-ions
Les peptides sont des molécules chargées. La purification par HPLC en phase inverse est réalisée en présence d’ions trifluoroacétate (tfa, CF3COO-) et permet d’isoler des peptides purs. La fraction de peptide pur est ensuite lyophilisée ce qui donne des préparations de peptides qui comprennent du trifluoroacétate (tfa, CF3COO-) comme contre-ion.
Services d’échange de l’anion TFA
Certaines applications nécessitent l’élimination du tfa. Nous proposons une option d’échange d’ions vers des sels d’acétate (CH3COO-) ou de chlorure (Cl-).
5- Contrôle qualité: peptides garantis
Nous avons conscience que la qualité et la fiabilité sont essentielles pour nos clients. C’est pourquoi aucun peptide ne quitte nos laboratoires s’il n’est pas conforme à nos normes strictes de contrôle de qualité à chaque étape du processus.
Le rapport de synthèse standard comprend une trace analytique HPLC confirmant le niveau de pureté, un spectre de masse montrant l’intégrité du peptide et les conditions de dissolution.
Des analyses supplémentaires peuvent être effectuées si nécessaire :
• Analyse élémentaire pour la teneur nette en peptides
• Teneur en tfa
• Analyse des acides aminés
• Teneur en eau
• RMN, CD et autres techniques avancées
Les peptides livrés sont garantis à 100 %.