Wir stellen vollständig charakterisierte Peptide für die Forschung in Mengen von wenigen « mg » bis zu mehreren « g » her. Der Großteil der Peptidsynthesen wird an der festen Phase (z.B. Wang-Harz) unter Verwendung der Fmoc Chemie hergestellt. Eine Peptid¬synthese in der flüssigen Phase setzen wir dann ein, wenn dies z.B. aufgrund spezieller struktureller Besonderheiten in der Peptidsequenz notwendig ist. Wir reinigen jedes ihrer Peptide durch RP-HPLC bis zum Erreichen des gewünschten Reinheitsgrades. Wir unterstützen Sie gerne bei der Auswahl des für Ihren speziellen Verwendungszweck am Besten geeigneten Reinheitsgrades. Alle von uns hergestellten Peptide werden nur als Forschungsreagenzien für den in vitro Gebrauch verkauft. Sie sind nicht für medizinische oder diagnostische Anwendungen zugelassen.
1• Peptidsynthesemaßstäbe
Die Tabelle beschreibt unsere am häufigsten durchgeführten Peptidsynthesemaßstäbe. Bitte fragen Sie uns nach einem Angebot für Ihre Peptidsynthese und geben Sie uns dazu ihre gewünschten Sequenz(en), Mengen und den von Ihnen gewünschten Reinheitsgrad der Peptide an. Wir werden sicherlich auch Ihnen mit einem sehr kompetitiven Angebot antworten können.
Kundenspezifische Peptidsynthese:
• Schneller turnaround
• 97%+ Erfolgsquoten
• Garantierte Qualität
| Peptidsyntheseangebot Unsere Preisgruppen (I-VI) in Abhängigkeit von der Peptidmenge (mg) | (I) (II) (III) (IV) (V) (VI) |
2 mg (minimale Menge) 5 mg bis 30 mg in Schritten von 5 mg 30 mg bis 100 mg in Schritten von 10 mg 0,1 g bis 1 g in Schritten von 50 mg 1 g bis 10 g in Schritten von 500 mg >10 g |
| Reinheitsgrad: | >70%,> 80%,> 90%,> 95% und 99% |
| Analysedaten: | HPLC Chromatogramm (220 nm), Massenspektrum (EI, MALDI-TOF) und Empfehlung eines für das Peptid geeigneten Lösungsmittels |
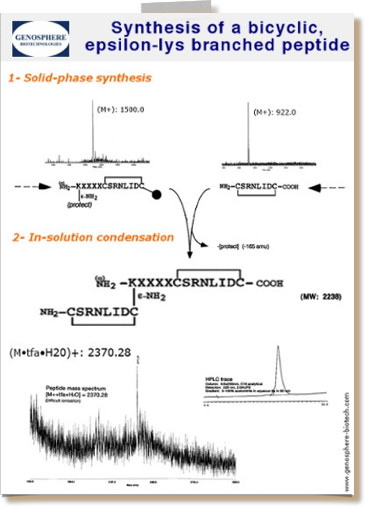
| Peptidlängen: | Standard: 5-30 AS ; Routine: 31-60 AS ; maximale: « about 100 AS » |
| Struktur: | Entschützte Termini (d.h. : freie NH2- und freie -COOH Gruppe ) |
| Gegenion: | Standard: trifluoroacetat (TFA) ; Option: Acetat oder Chlorid |
| Form: | Lyophilisiertes Pulver |
2• Peptidreinigung durch Reverse phase HPLC (RP-HPLC)
Durch die Kombination verschiedener Reinigungsschritte können wir Ihnen 5 garantierte Reinheitsstufen anbieten >70%, >80%, >90%, >95% und unseren einzigartigen “ultra-pure >99% “ Reinheitsgrad für besonders anspruchsvolle Experimente.
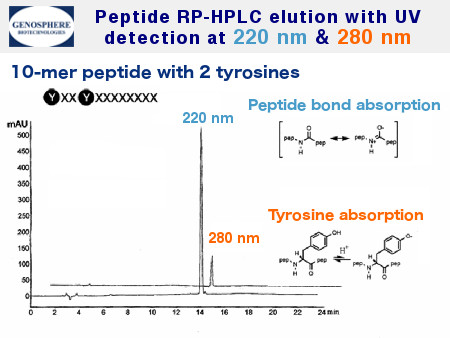
Die Reinigungsschritte werden durch präparative oder semi-präparative RP- HPLCdurchgeführt. Wir verwenden typischerweise C8 oder C18 Säulen mit einem linearen Gradienten von Acetonitril in 0.1% wässriger TFA. Die Elution der Peptide wird bei UV = 220 nm detektiert; bei Peptiden die aromatische Aminosäuren enthalten wird die Detektions-Wellenlänge erhöht (Abb 2).
Das rohe Peptidsyntheseprodukt enthält zunächst noch Nebenprodukte , die von unvollständigen Kopplungsschritten, Oxidationsprozessen oder der Hydrolyse von Seitenketten während den Abspaltungs- und Entschützungsschritten herrühren. Das Ausmaß an Verunreinigungen ist wesentlich von der Peptidlänge und der primären Sequenzabfolge des Peptides abhängig.
Folgende Hinweise sollen Ihnen bei der Auswahl des für ihre Applikation geeigneten Reinigungsgrades helfen.
Reinigungsgrades und Applikation
Reinheit >70%
Erstes Peptid-Screening mit großer Reichweite ; Polyklonale Antikörper Herstellung mit Peptiden < 20 AS, “custom peptide libraries”.
Reinheit >80%
Peptid-Screening biochemische Assays ; “qualitative Immunoassays” (ELISA) ; Polyklonale Antikörper Herstellung mit Peptiden > 20AS; “.
Reinheit >90%
Erste Peptid-Bioassay-Tests ; Struktur-Aktivitäts Studien; qualitative biochemische Assays (Enzymaktivität, Spezifität) ; Polyklonale mono-spezifische Antikörper; Herstellung von Affinitätssäulen.
Reinheit >95%
Allgemein empfohlen bei der Herstellung von markierten Peptiden (z.B. FITC-Peptid), quantitativen Immunoassays (ELISA); quantitativen biochemische Assays (Enzymaktivität , Kinetik) und zur vorläufigen Strukturanalyse (NMR).
Reinheit >99%, ultra-pure
Sensitive Bioassays; Zellkulturassays; quantitative Bioassays; Strukturstudien (Kristallographie, NMR).
3• Die Enden von Peptiden
Der N-Terminus ist der Endpunkt eines Peptids, der eine freie Aminogruppe (-NH2) besitzt, während der C-Terminus der Endpunkt ist, der eine freie Carboxylgruppe (-COOH) besitzt. Bei der Konzeption eines Peptids sollte man sich fragen, welche Enden für die jeweilige Anwendung am besten geeignet wären. Je nach den Anforderungen, die gegebenenfalls an die Gesamtladung des Peptids oder an die Stabilität gegenüber Exopeptidase-Aktivitäten gestellt werden, kann eine Blockierung der N- und/oder C-Enden in Betracht gezogen werden.
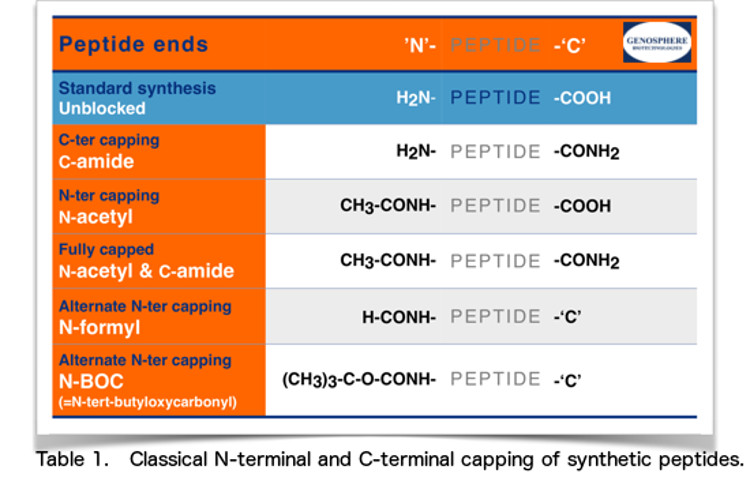
• Standardsynthesen: Unblockierte Enden
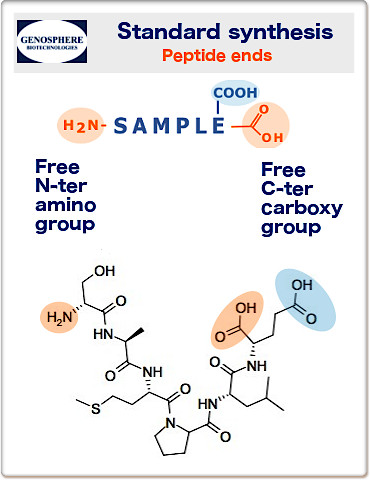
Unsere Peptide werden normalerweise mit unblockierten Enden synthetisiert:
N-Terminus: freie Aminogruppe (H2N-) und C-Terminus: frei Carboxygruppe (-COOH).
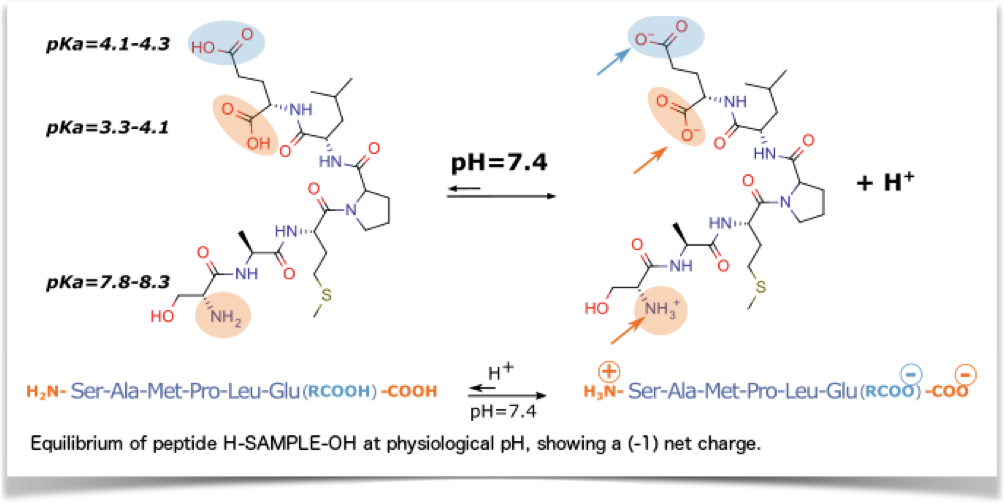
Die pKa-Werte der Alpha-Aminogruppe und der Carbonsäuregruppe zeigen, dass die Peptidendenden bei physiologischem pH-Wert in der Regel elektrisch geladen sind.
• Blockierung und Schutz der Enden
In manchen Fällen kann es besser sein, diese elektrischen Ladungen durch die Verwendung von “blockierenden” Gruppen zu neutralisieren. Zu diesem Zweck werden die Peptid-Enden häufig modifiziert durch :
N-terminale Acetylierung und/oder C-terminale Amidierung.
Peptide mit N-Acetylgruppen und C-Amid ahmen auf diese Weise die internen Sequenzen nach, da sie ungeladene Enden haben. Außerdem verbessern diese blockierenden Gruppen die Widerstandsfähigkeit gegen enzymatischen Abbau. Es ist anzumerken, dass diese Neutralisierung der Ladung(en) häufig auch zu einer Verringerung der Löslichkeit führt.
In anderen Fällen kann es wünschenswert sein, den N- oder C-Terminus so zu modifizieren, dass die enzymatische Hydrolyse verhindert oder verringert wird, insbesondere wenn die Peptide für die Verwendung in biologischen Systemen bestimmt sind, in denen enzymatische Aktivität vorhanden ist, z. B. Körper- oder Zellflüssigkeiten, Bakterien etc.
Peptidasen können je nach Proteolysemuster in Endo- oder Exopeptidasen gruppiert werden. Exopeptidasen katalysieren die Entfernung von Aminosäuren (oder kurzen Peptiden) am Ende einer Polypeptidkette durch die Hydrolyse der Peptidbindungen.
Diese Enzyme sind in der Natur weit verbreitet und können in Untergruppen unterteilt werden. Genauer gesagt hydrolysieren Aminopeptidasen die Aminosäuren am N-Terminus eines Peptids, während Carboxypeptidasen die Aminosäuren am C-Terminus hydrolysieren.
Auch hier werden N-Acetylierung und C-Amidierung üblicherweise verwendet, um die Peptid-Enden vor der Hydrolyse durch Exopeptidasen zu schützen.
Andere N-terminale Modifikationen, einschließlich N-Pyroglutamylierung, Lipidierung, Zyklisierung und PEGylierung, haben die Biostabilität von Peptiden erhöht.

4• Gegenion
Die Reinigung der Peptide mittels RP-HPLC führt zu der Isolation von reinen Peptiden, die im nachfolgenden Schritt gefriergetrocknet werden. Die so erhaltenen getrockneten Peptide enthalten CF3COO- (TFA) als Gegenion. Das TFA entstammt dabei dem Elutionsmittel der RP-HPLC. Einige Anwendungen machen es jedoch erforderlich, dass das TFA-Gegenion gegen ein anderes Gegenion ausgetauscht werden muß.
TFA-Austauschdienste
Wir bieten daher die Möglichkeit an das TFA-Anion gegen ein Acetat-Anion (CH3COO-) oder ein Chlorid-Ion (Cl-) auszu-tauschen.
5• Qualitätskontrolle: Garantierte Peptide
Wir verstehen dass Qualität und Zuverläßlichkeit zentrale Kriterien für unsere Kunden sind Aus diesem Grund verläßt kein Peptid unser Labor, das nicht unseren stringenten QC Standards entspricht.
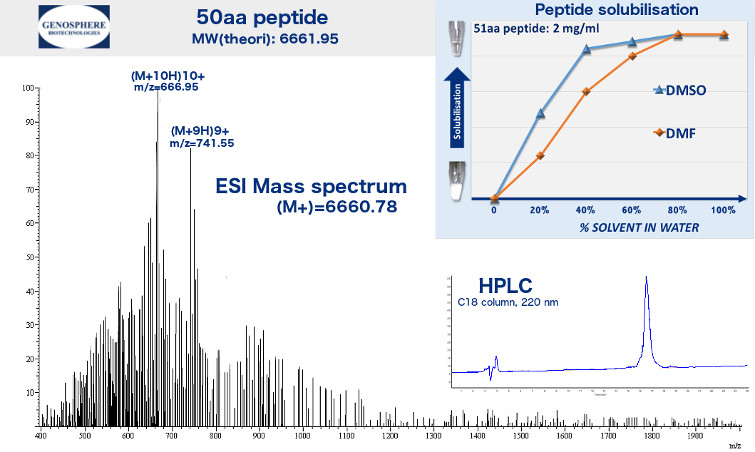
Der Synthese Report besteht aus 3 Teilen : Ein analytisches HPLC Chromatogramm, das die Reinheit des Produktes dokumentiert. Ein Massenspektrum , das die Vollständigkeit der gewünschten Peptidlänge darstellt (Integrität) und einem Vorschlag zur Wahl des Lösungsmittels, in dem das Peptid gelöst werden kann.
Es können auch andere Analysen durchgeführt werden:
• Elementaranalyse für den Netto-Peptidgehalt
• Analyse auf tfa-Gehalt
• Analyse des Aminosäuregehalts
• Analyse des Wassergehalts
• NMR, CD und andere fortgeschrittene Techniken
Ihre gelieferten Peptide sind zu 100 % garantiert.