L’expression de protéines chez E. Coli est la plus économique et la plus couramment utilisée. Il est particulièrement adapté à la préparation d’antigènes, de ligands, de cytokines ou de protéines bactériennes. La relative simplicité du système et la connaissance de la génétique des hôtes en ont fait un système de choix. Par ailleurs, E. coli a courte période de culture et offre la possibilité d’obtenir des rendements élevés.
Au cours des dernières décennies, le système d’expression chez E. coli a été développé et est bien documenté par son utilisation intensive en recherche et dans l’industrie pour un grand nombre d’expression de protéines recombinantes.
Description du service
La production de protéine recombinante comprend plusieurs étapes allant du gène à la protéine purifiée, comme décrit dans le tableau ci-dessous.
Le délai de production est d’environ 8 à 10 semaines.
| Description | Matériel résultant | Délai d'exécution moyen (*) |
| Synthèse de gène | ||
| - Optimisation des codons - Synthèse du gène - Clonage dans le plasmide standard pUC - Séquençage complet |
Gène cloné, synthétisé et vérifié | 2 semaines |
| Sous-clonage pour l'expression | ||
| - Préparation des plasmides - Sous-clonage - Sélection du clone - Séquençage complet |
Vecteur plasmidique avec gène cible cloné | .2 semaines |
| Expression du pilote | ||
| - Expériences pilotes d'expression et d'optimisation - Choix de l'hôte le plus approprié - Ajustement des conditions de culture - Détermination des rendements et du comportement des protéines |
10-50 µg de protéine semi-purifiée | 2-3 semaines |
| Expression et purification | ||
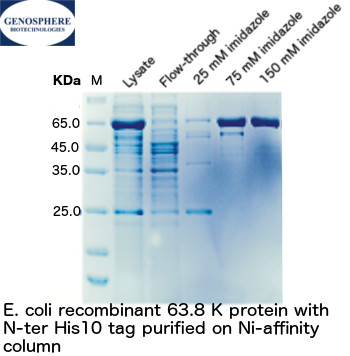
| - Expression - Extraction de la protéine - Purification de la protéine - SDS-PAGE, WESTERN blot |
Protéine purifiée | 2-3 semaines |
(*) Temps de production moyen pour un projet moyennement difficile. Le délai d'exécution réel varie en fonction des caractéristiques du projet..