Sintetizamos péptidos completamente caracterizados para la investigación. Proponemos cantidades desde algunos miligramos hasta varios gramos. La mayoria de las síntesis se realizan en fase sólida sobre resina, utilizando la química Fmoc. Sin embargo, se puede realizar la síntesis en fase líquida si la estructura o la secuencia lo necesita. Los péptidos son purificados después, por HPLC en fase inversa, hasta varios niveles de pureza. Estamos a su disposición para aconsejarle sobre el nivel de pureza óptimo acorde con sus aplicaciones. Nuestros péptidos no deben utilizarse para aplicaciones médicas o diagnósticas sino, únicamente, para la investigación in vitro.
1• Gama de síntesis estándar
La tabla describe nuestras síntesis clásicas más solicitadas. Póngase en contacto con nosotros con sus secuencias, cantidad y nivel de pureza y siempre le responderemos con una oferta muy competitiva.
- • Plazos de síntesis muy breves.
- • 97%+ de éxito en la síntesis.
- • Calidad garantizada.
| Nuestros grupos de precios (I-VI) dependiendo de la cantidad de péptido (mg) | (I) (II) (III) (IV) (V) (VI) |
2 mg (cantidad mínima) 5 mg - 30 mg en incrementos de 5 mg 30 mg - 100 mg en incrementos de 10 mg 0,1 g - 1 g en incrementos de 50 mg 1 g - 10 g en incrementos de 500 mg >10 g |
| Niveles de pureza: | >70%, >80%, >90%, >95% y >99% |
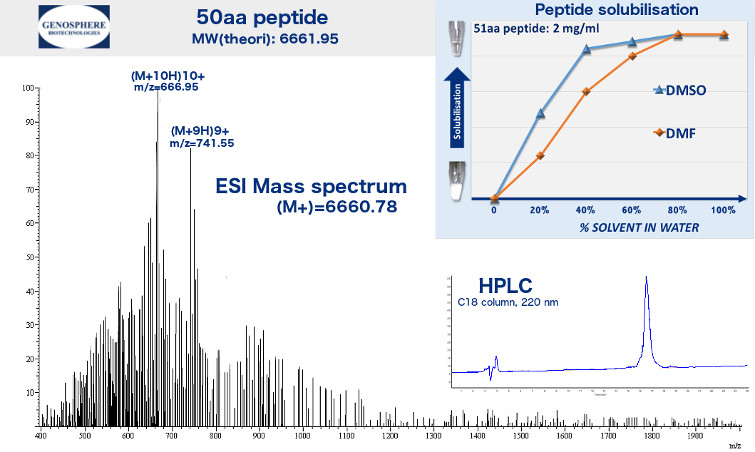
| Datos analíticos: | Perfil HPLC (220 nm), espectro de masas (MALDI-TOF, EI), prueba de solubilidad |
| Longitud de cadena: | Estándar: 5 a 30 aa ; frecuente: 31 a 60 aa ; máxima: unos 100 aa |
| Estructura: | Extremos libres (i.e. NH2- y -COOH ) |
| Contraiones: | Estándar: trifluoroacetate (tfa) ; Option: acetate o cloruro |
| Forma: | Liofilizados |
2• Purificación por HPLC en fase inversa
Los niveles garantizados de pureza obtenidos por cromatografía líquida de alta resolución (HPLC) son: >70%, >80%, >90%, >95% y un nivel único ultra-puro >99%.
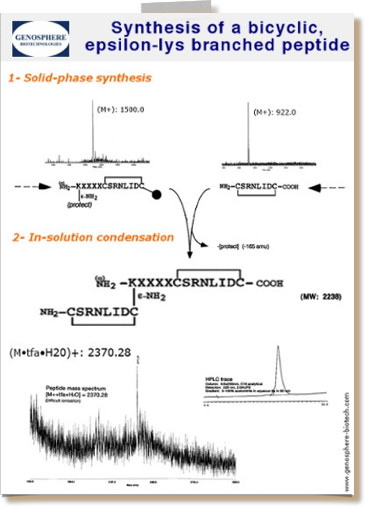
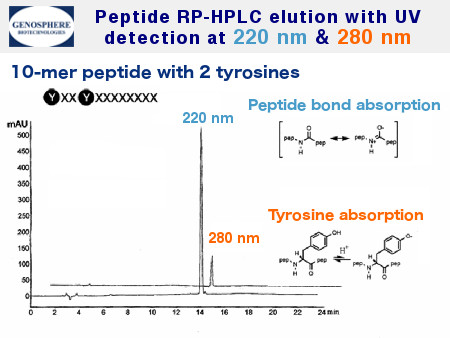
La purificación se realiza por HPLC en fase inversa a escala preparativa o semipreparativa generalmente en las siguientes condiciones: columnas C8 o C18, elución por gradientes lineales de acetonitrilo en solución ácuea de TFA 0,1% y detección UV a 220 nm.
Para péptidos que incluyen aminoácidos aromáticos, la detección UV se efectua a una longitud de onda superior .
El péptido sintético crudo contiene subproductos que resultan de los ciclos de acoplamiento abortados (i.e. cadenas truncadas) y, después, de la oxidación, modificación o hidrólisis de las cadenas laterales occuriendo durante el corte y la deprotección. La cantidad de impurezas depende de la secuencia y de la longitud del péptido.
Estamos a su disposición para aconsejarle sobre el nivel de pureza óptimo acorde con sus aplicaciones, en conformidad con las líneas generales siguientes.
Aplicaciones experimentales y niveles de pureza recomendados
Pureza >70%
Cribado de péptidos; producción de anticuerpos policlonales; muestreo preliminar de una biblioteca de péptidos; niveles de pureza superiores son generalmente preferibles para péptidos de más de 20 aa.
Pureza >80%
Ensayos bioquímicos de cribado; inmunoensayos cualitativos (ELISA, competencia, depleción…); producción de anticuerpos policlonales con péptidos largos.
Pureza >90%
Bioensayos preliminares de péptidos candidatos; producción de anticuerpos policlonales monoespecíficos; fabricación de columnas de afinidad; estudios de estructura-actividad; pruebas bioquímicas cualitativas (actividad enzimática, especificidad…).
Pureza >95%
Inmunoensayos cuantitativos (ELISA, competencia, depleción…); ensayos bioquímicos cuantitativos (actividad enzimática, cinética…); generalmente recomendados para péptidos modificados; análisis estructural preliminar (RMN,…).
Pureza >99%, ultrapuro
Ensayos de cultivos celulares; bioensayos cuantitativos; ;estudios estructurales (Cristalografía, RMN…).
3• Extremos de péptidos
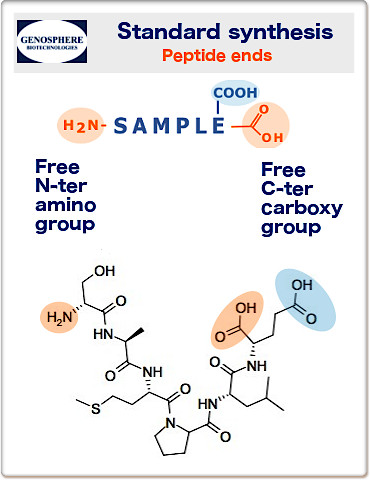
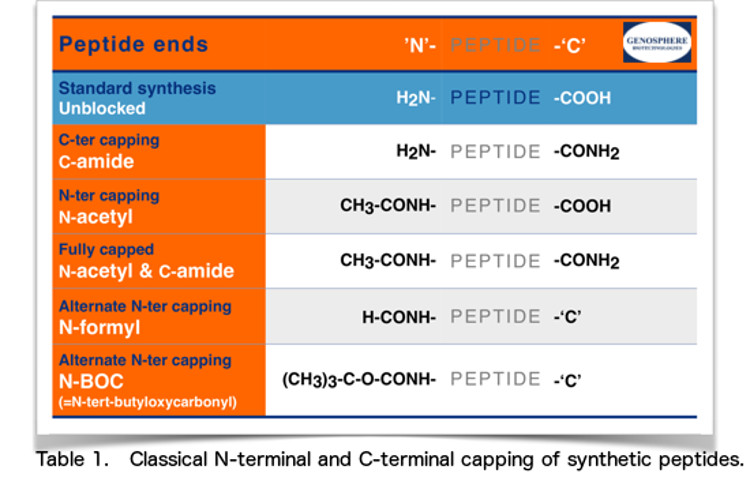
El N-terminal es el extremo de un péptido que tiene un grupo amino libre (-NH2), mientras que el C-terminal es el extremo que tiene un grupo carboxilo libre (-COOH). Cuando se diseña un péptido, hay que considerar qué extremos son los más adecuados para la aplicación en cuestión. Dependiendo de los requisitos, si los hay, para la carga global del péptido o para la estabilidad con respecto a las actividades exopeptidasas, se puede considerar el bloqueo de los extremos N- y/o C-terminal.
• Síntesis estándar: extremos sin bloquear
Nuestros péptidos se sintetizan normalmente con extremos no bloqueados:
Extremo N-terminal: grupo amino (H2N-) y extremo C-terminal: grupo carboxílico (-COOH).
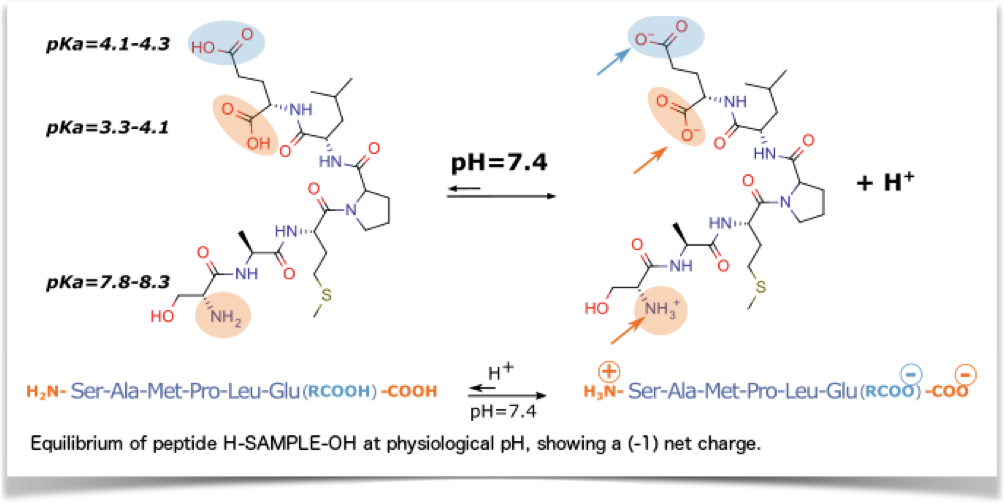
Los valores de pKa del grupo alfa-amino y del grupo ácido carboxílico indican que los extremos del péptido están generalmente cargados eléctricamente a pH fisiológico.
• Bloqueo y protección de los extremos
En algunos casos, puede ser preferible neutralizar estas cargas eléctricas utilizando grupos “bloqueadores”. Para ello, los extremos de los péptidos suelen modificarse mediante :
Acetilación N-terminal y/o amidación C-terminal.
Los péptidos con grupos N-acetilo y C-amida imitan así las secuencias internas porque tienen extremos sin carga. Además, estos grupos bloqueadores mejoran la resistencia a la degradación enzimática. Cabe señalar que esta neutralización de la(s) carga(s) suele conllevar también una disminución de la solubilidad.
En otros casos, puede ser deseable modificar el N- o el C-terminal de forma que se impida o reduzca la hidrólisis enzimática, especialmente cuando los péptidos están destinados a utilizarse en sistemas biológicos en los que existe actividad enzimática, por ejemplo, fluidos corporales o celulares, bacterias, etc.
Las peptidasas pueden agruparse según el patrón de proteólisis en endo- o exo-peptidasas. Las exopeptidasas catalizan la eliminación de aminoácidos (o péptidos cortos) del extremo de una cadena polipeptídica por hidrólisis de los enlaces peptídicos.
Estas enzimas están ampliamente distribuidas en la naturaleza y pueden dividirse en subgrupos. En concreto, las aminopeptidasas hidrolizan los aminoácidos N-terminales de un péptido, mientras que las carboxipeptidasas hidrolizan los aminoácidos C-terminales.
De nuevo, la N-acetilación y la C-amidación se utilizan habitualmente para proteger los extremos peptídicos de la hidrólisis por exopeptidasas.
Para aumentar la bioestabilidad de los péptidos se han utilizado otras modificaciones N-terminales, como la N-piroglutamilación, la lipidación, la ciclación y la PEGilación.

4• Contra-iones
Los péptidos son moléculas cargadas. La purificación estándar por HPLC en fase inversa se realiza en disolventes que incluyen trifluoroacetato (tfa, CF3COO-) y permite el aislamiento de péptidos puros. La fracción de péptidos puros se liofiliza posteriormente, dando lugar a una preparación de péptidos que incluye trifluoroacetato (tfa, CF3COO-) como contra-iones. Algunas aplicaciones requieren la eliminación del tfa.
Servicios de intercambio TFA
Ofrecemos la opción de intercambio iónico con sales de acetato (CH3COO-) o de cloro (Cl-).
5• Control de calidad: péptidos garantizados
Estamos muy concienciados por la calidad y la fiabilidad de los productos deseados por nuestros clientes. Por eso, ningún péptido sale de nuestro laboratorio a no ser que nuestros criterios de calidad sean satisfechos rigurosamente.
El informe de síntesis estándar incluye una traza analítica de HPLC que verifica la pureza, un espectro de masas que garantiza la integridad del péptido de longitud completa deseado y las condiciones de disolución.
Pueden realizarse otros análisis:
• Análisis elemental del contenido neto de péptidos
• Contenido en tfa
• Análisis de aminoácidos
• Contenido de agua
• RMN, CD y otras técnicas avanzadas
Los péptidos suministrados están garantizados al 100%.