Notre société a acquis une grande expérience dans la synthèse de peptides difficiles aux structures sophistiquées. Nos peptides sont réputés pour leur grande stabilité et l’excellente activité biologique généralement observée dans de nombreux domaines de recherche.
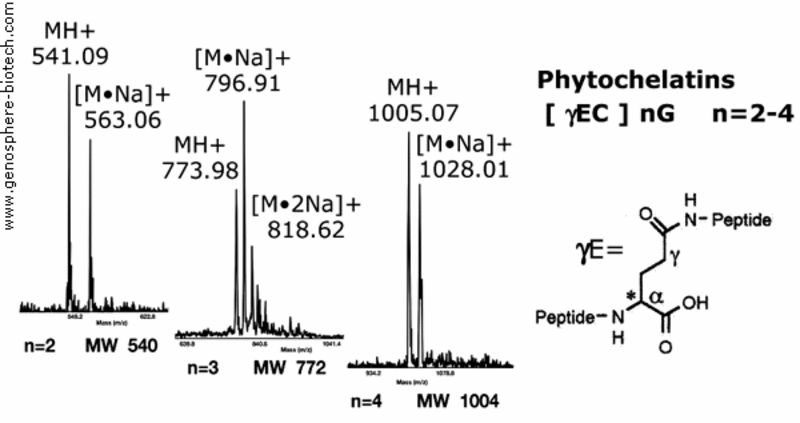
Spectres de masse de phytochelatines synthétiques liant les métaux et de peptides végétaux.
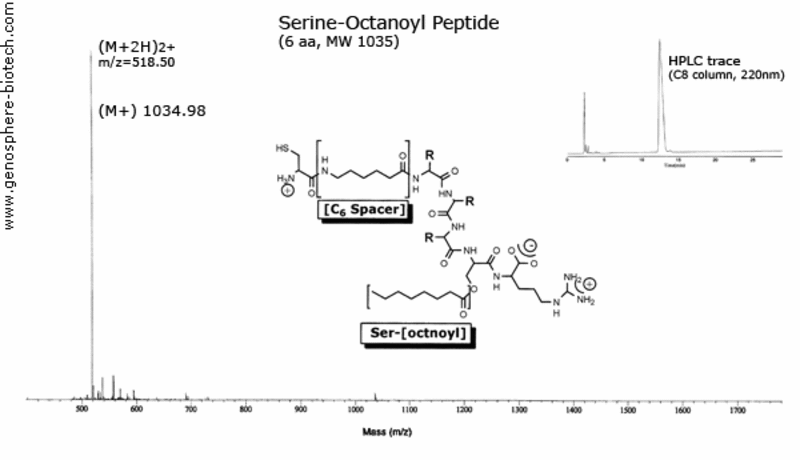
Spectre de masse et trace HPLC du peptide modifié
avec un espacement de sérine-octanoyle et d’acide aminohexanoïque.
Peptides cycliques
Les peptides cycliques suscitent de plus en plus d’intérêt du fait d’une bonne stabilité chimique et d’une résistance considérablement accrue aux dégradations enzymatiques naturelles. La conformation de ces peptides est plus rigide que celle de leurs analogues linéaires, ce qui pourrait expliquer en partie les accroissements d’activité biologique observés. Nous réalisons fréquemment des modifications peptidiques par cyclisation tête-à-queue des extrémités amine et carboxylique. La cyclisation par formation dirigée de ponts disulfures intramoléculaires (jusqu’à deux par molécule) est également très courante ; le suivi par spectrométrie de masse de la réaction permet de garantir une cyclisation totale.
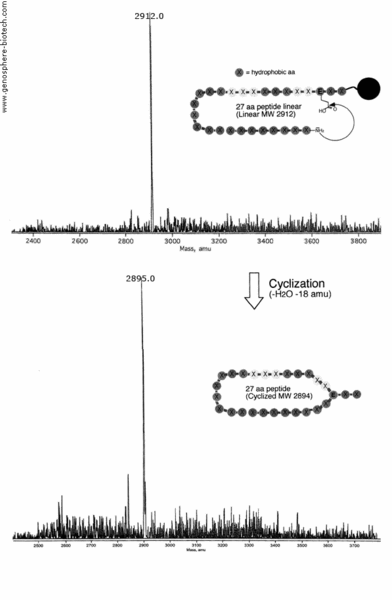
La cyclisation de l’amine N-terminale à l’acide glutamique interne d’un peptide de 27 aa contenant 21 résidus hydrophobes (masse molaire théorique 2894) a été préparée (100 mg) avec un niveau de pureté >95% et un échantillon a été analysé par MALDI-TOF MS. La MS montre une perte de H2O (-18 amu) par condensation pour donner le produit désiré avec un ion moléculaire à m/z 2895.0.
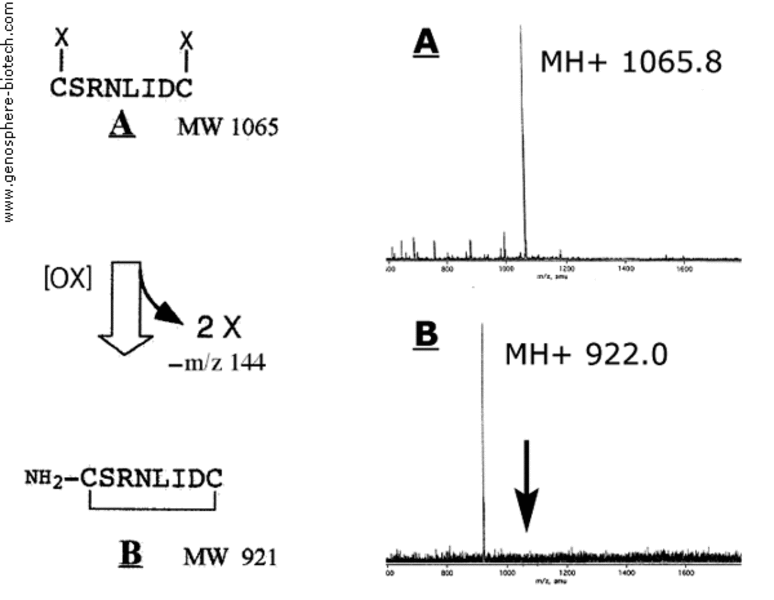
Spectres de masse du précurseur linéaire protégé (A) et du peptide cyclique final (B).
Marqueurs et espaceurs
Selon votre application, nous pouvons vous préparer des peptides biotinylés ou fluorescents avec divers espaceurs. Nous proposons des espaceurs C3, C6, C12, C18, ou des dérivés du Polyéthylèneglycol (PEG).
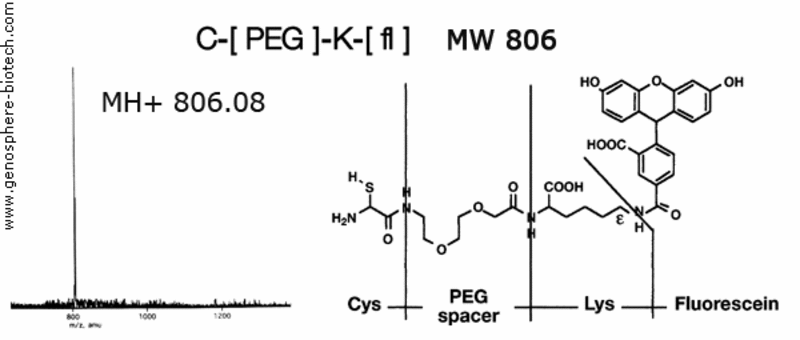
Spectre de masse d’un peptide fluorescent contenant un espaceur PEG.
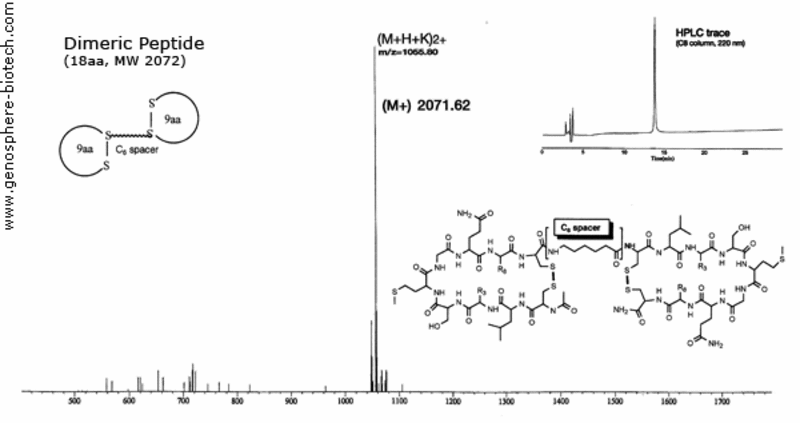
Spectre de masse et trace HPLC d’un peptide cyclique dimérique lié à un espaceur d’acide aminohexanoïque.
Extrémités des peptides
Nos peptides sont habituellement synthétisés en laissant les extrémités libres i.e. avec les groupes amine et acide carboxylique.
Mais dans certains cas, il peut être nécessaire de modifier les extrémités.
Les groupes N-acetyl et C-amide sont souvent utilisés car ils sont électriquement neutres comme la structure interne ; ils améliorent aussi la résistance à la dégradation enzymatique.
| Extrémité-N (par défaut NH2) | Extrémité-C (par défaut COOH) |
| acétyl, formyl | amide |
| myristoyl, palmitoyl | hydroxyl |
| carboxyl | thioester |
| 2-furoyl | (…) |
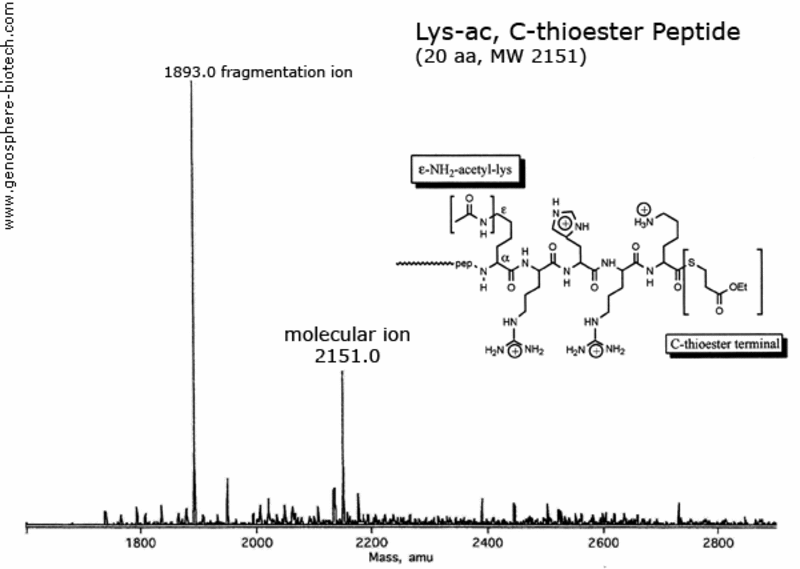
Spectre de masse d’un peptide de 20 aa avec une lysine acétylée et une extrémité C bloquée par un thioester.
Modifications possibles
Genosphere Biotechnologies propose un large éventail de modifications comme indiqué ci-après.
De nombreuses autres modifications sont possibles, n’hésitez pas à nous contacter.
| Acides aminés spéciaux | Modifications chimiques |
| Forme D | Phosphorylation: Tyr, Ser, Thr |
| Hydroxyproline | Biotine, DNP |
| Pyroglutamine | Anilide C-terminale |
| Méthyl-, acétyl-lysine | Benzyloxycarbonylation |
| 4-Bromo-, 4-Nitro-phe | Nitrosation |
| beta-alanine | N-Méthylation |
| Marquage fluorescent | Couplage macromoléculaire |
| Coumarine | Acides gras |
| Fluorescéine | Protéines: KLH, BSA, OVA |
| Rhodamine | Cyclisation |
| DANSYL | Pont disulfure cys-cys |
| NBD | Cycle lactame Nter-Cter |
| DABCYL | Lactame interne, lactone |
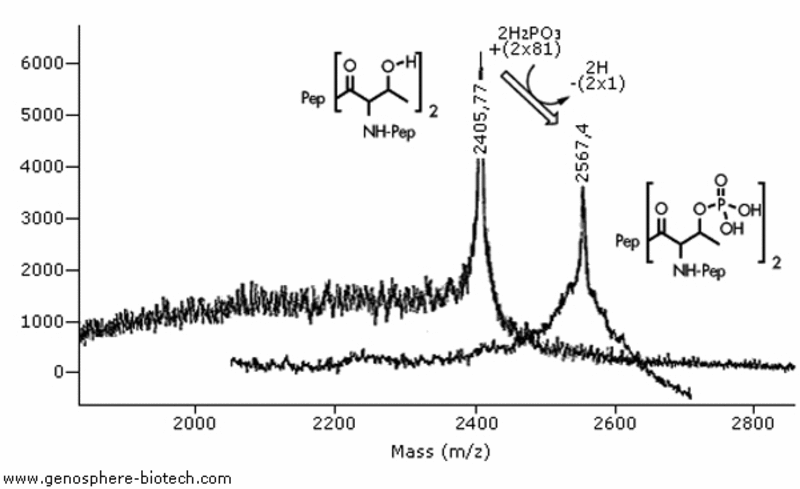
Analyse MALDI-TOF MS de deux peptides 20-aa avec deux résidus thréonine : (a) peptide non modifié, masse molaire théorique de 2404 et (b) peptide avec des thréonines phosphorylées ; masse molaire théorique de 2564.
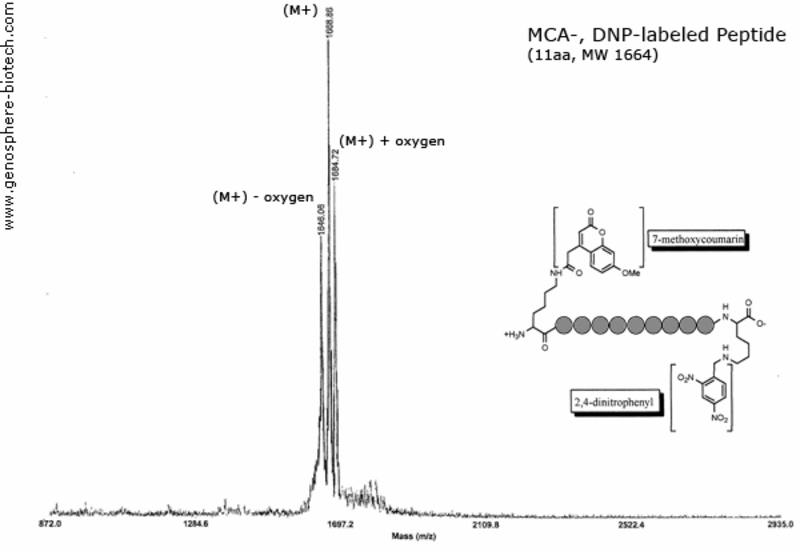
Spectre de masse d’un peptide doublement marqué : 7-méthoxycoumarine (MCA) et 2,4-dinitrophényle (DNP) liés par l’ε-amine des résidus lysine.

