Nuestra empresa ha adquirido una amplia experiencia en la síntesis de péptidos difíciles con estructuras sofisticadas. Nuestros péptidos son reconocidos por su alta estabilidad y la excelente actividad biológica generalmente observada en muchas áreas de investigación.
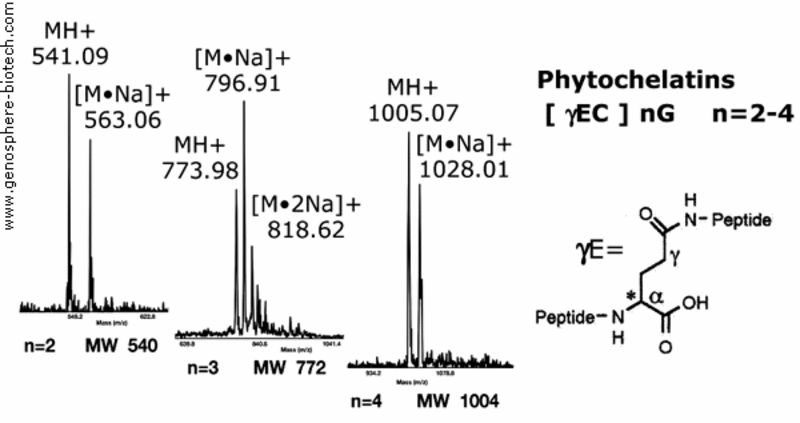
Espectros de masas de fitoquelatinas sintéticas fijadoras de metales y péptidos vegetales.
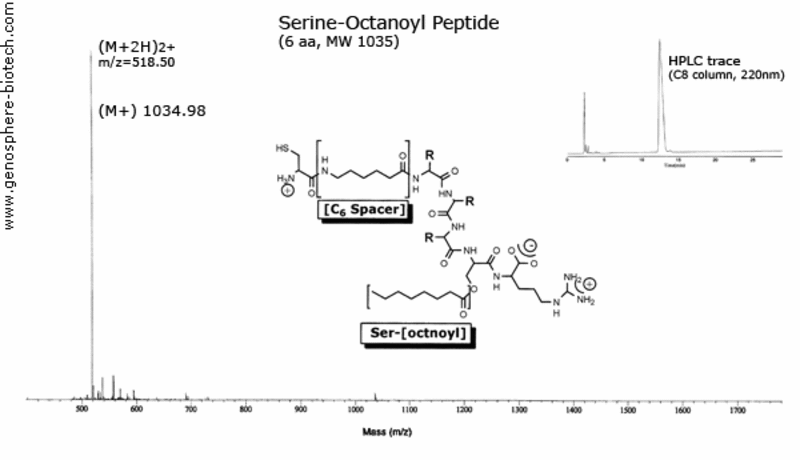
Espectro de masas y traza HPLC de péptido modificado
con un espaciador de serina-octanoil y ácido aminohexanoico.
Péptidos cíclicos
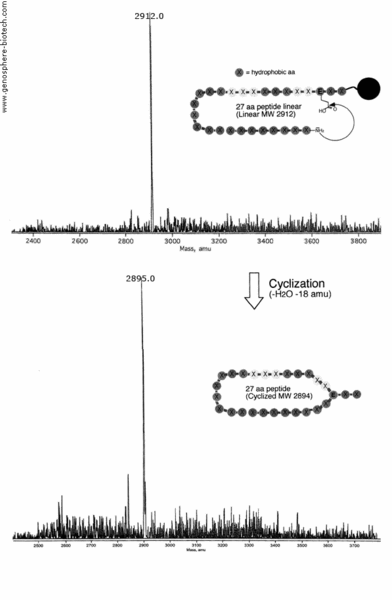
Se preparó la ciclación de amina N-terminal a ácido glutámico interno de un péptido de 27 aa que contiene 21 residuos hidrofóbicos (masa molar teórica 2894) (100 mg) con una pureza >95% y se analizó una muestra por MALDI-TOF MS. La EM muestra una pérdida de H2O (-18 amu) por condensación para dar el producto deseado con un ion molecular a m/z 2895,0.
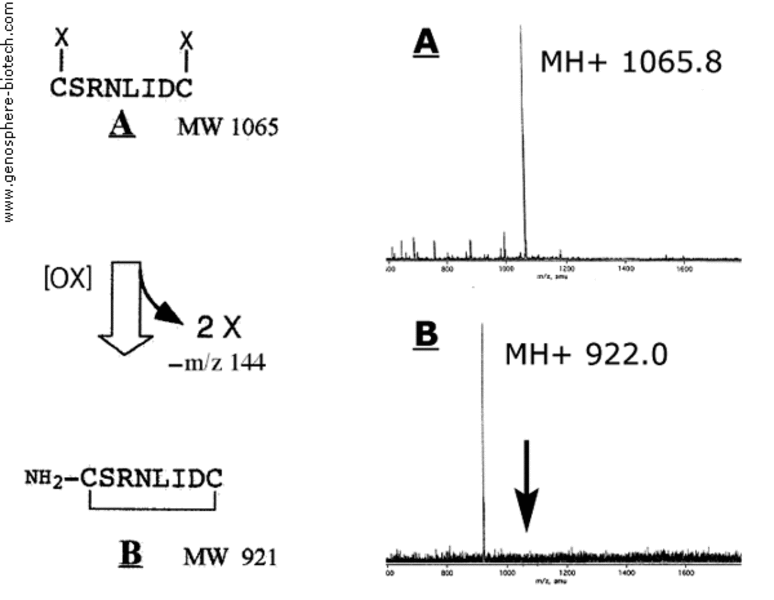
Espectros de masas del precursor lineal protegido (A) y del péptido cíclico final (B).
Marcajes y espaciadores
Dependiendo de su aplicación, podemos preparar péptidos biotinilados o fluorescentes con varios espaciadores. Ofrecemos espaciadores C3, C6, C12, C18 o derivados de polietilenglicol (PEG).
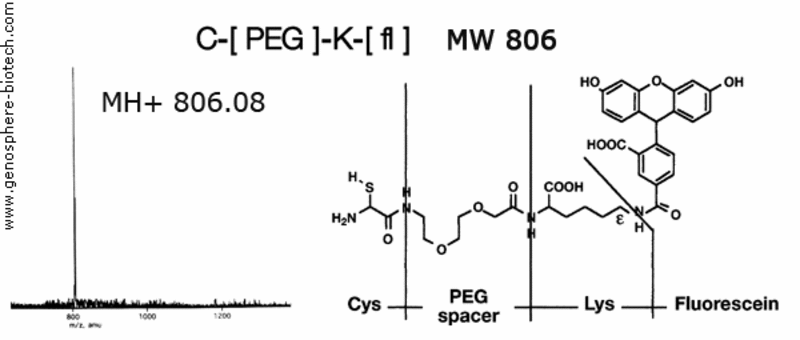
Espectro de masas de un péptido fluorescente que contiene un espaciador de PEG.
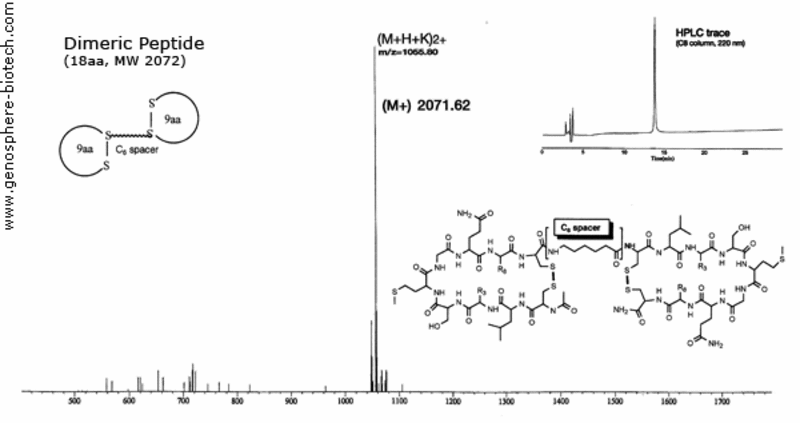
Espectro de masas y traza HPLC de un péptido cíclico dimérico unido a un espaciador de ácido aminohexanoico.
Extremos de los péptidos
Se sintetizan habitualmente los péptidos dejando los extremos libres (i.e. NH2- y -COOH).
Sin embargo, puede ser interesante modificar los extremos o bloquear a uno de ellos.
Se utiliza a menudo N-acetilación y C-amidación porque estos grupos son eléctricamente neutros como la estructura interna. Además, mejoran la resistencia a la degradación enzimática.
| Fin-N (por defecto NH2) | Fin-C (por defecto COOH) |
| acetyl, formyl | amide |
| myristoyl, palmitoyl | hydroxyl |
| carboxyl | thioester |
| 2-furoyl | (…) |
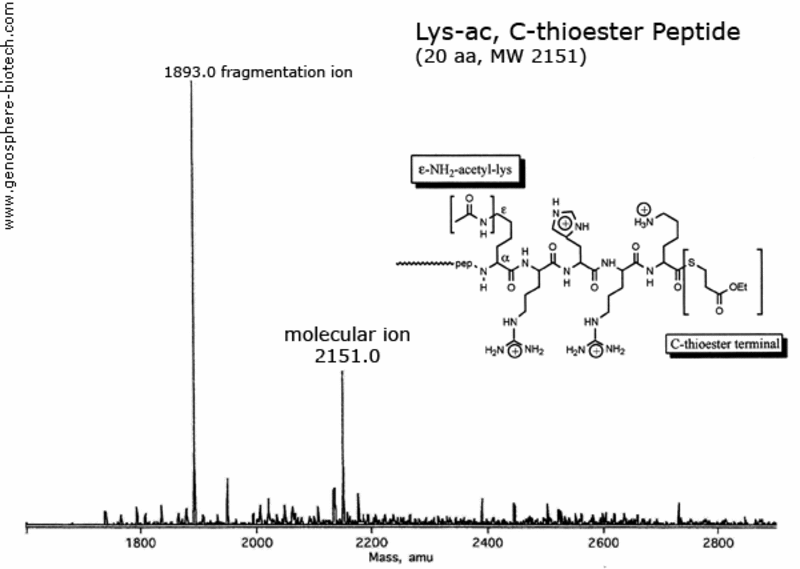
Espectro de masas de un péptido de 20 aa con una lisina acetilada y un C-terminal bloqueado por tioéster.
Posibles modificaciones
Genosphere Biotechnologies ofrece una amplia gama de modificaciones de péptidos, como se indica a continuación.
Muchas otras modificaciones son posibles, no dude en ponerse en contacto con nosotros..
| Aminoácidos especiales | Modificaciones químicas |
| D-form | Phosphorylation: Tyr, Ser, Thr |
| Hydroxyproline | Biotin, DNP |
| Pyroglutamine | Anilide C-terminal |
| Methyl-, acetyl-lysine | Benzyloxycarbonylation |
| 4-Bromo-, 4-Nitro-phe | Nitrosation |
| beta-alanine | N-Methylation |
| Marcaje fluorescente | Acoplamiento macromolecular. |
| Coumarin | Fatty acids |
| Fluorescein | Proteins: KLH, BSA, OVA |
| Rhodamine | Ciclismo |
| DANSYL | cys-cys disulfide bridge |
| NBD | Head to tail cycle |
| DABCYL | Internal lactam, lactone |
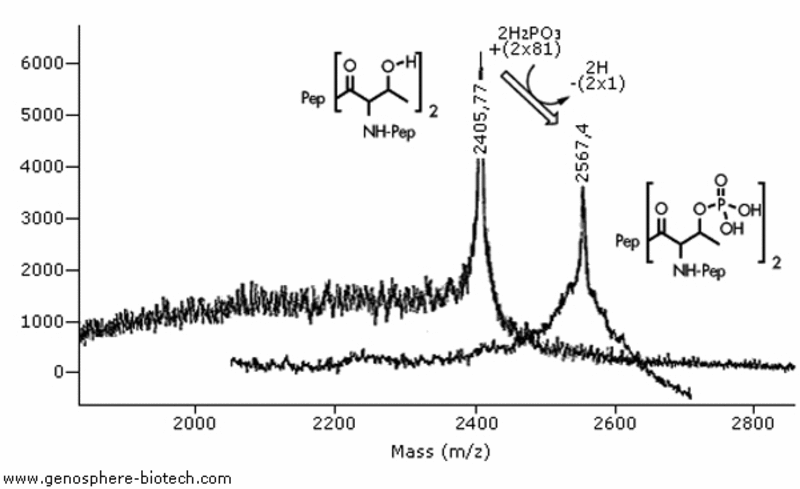
Análisis MALDI-TOF MS de dos péptidos 20-aa con dos residuos de treonina: (a) péptido no modificado, masa molar teórica 2404 y (b) péptido con treoninas fosforiladas; masa molar teórica 2564.
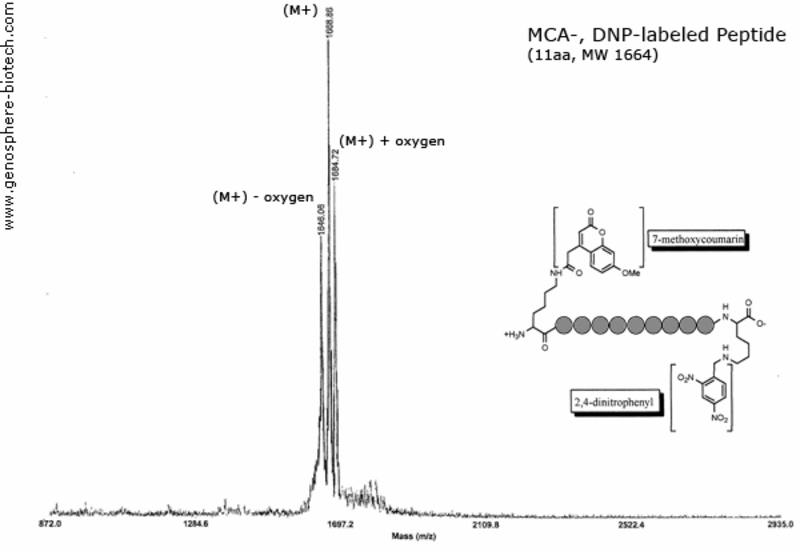
Espectro de masas de un péptido doblemente marcado: 7-metoxicumarina (MCA) y 2,4-dinitrofenil (DNP) unidos por la ε-amina de los residuos de lisina.

