Unsere Firma hat sich extensive Erfahrungen bei der Durchführung von schwierigen und anspruchsvollen Synthesen von Forschungspeptiden erworben. Unsere synthetischen Peptide sind im allgemeinen sehr stabil und zeichnen sich bei vielen wissenschaftlichen Anwendungen durch ihre hohe biologische Aktivität aus.
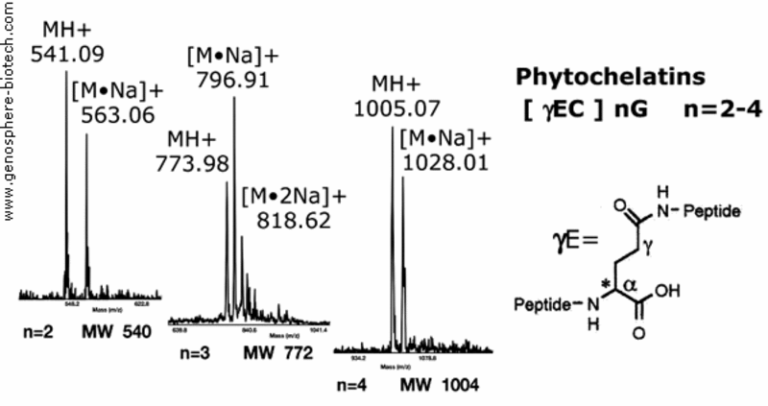
Massenspektren synthetischer metallbindender pflanzlicher Phytochelatinepeptide.
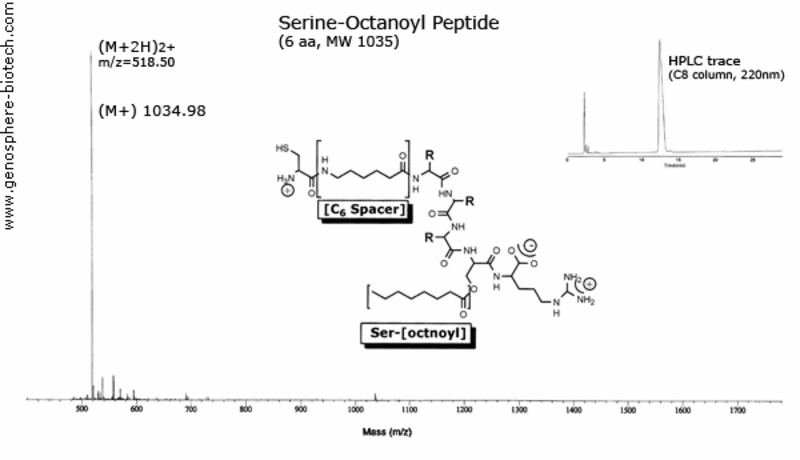
Massenspektrum und HPLC Chromatogramm eines modifizierten Peptids mit Serine-octanoyl- und Aminohexansäure –(C6)-Spacer.
Zyklische Peptide
Zyklische Peptide haben, aufgrund ihrer chemischen Stabilität und ihrem deutlich erhöhten Widerstand gegenüber enzymatischen Abbauprozessen in Zellkulturexperimenten, große Beachtung gefunden. Die ringförmige Konformation der zyklischen Peptide ist starrer im Vergleich zu ihren offenenkettigen Peptidanalogen und daraus läßt sich sicher ein Teil der beobachteten verbesserten Stabilität und Aktivität dieser Peptide erklären. Wir bieten routinemäßig die Herstellung von zyklischen Peptiden mit “head-to- tail” Ringschlüssen an, sowie auch die Herstellung von Peptiden mit einer oder mehreren cys-cys Disulfidbrücken, wie sie zum Beispiel im Insulin oder in Metallothioneinen zu finden sind.
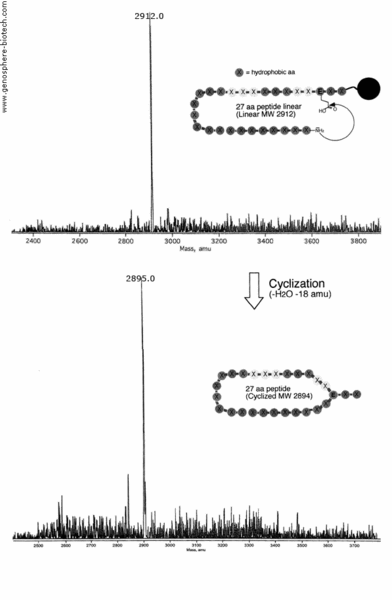
Die “N-terminale Amin-to- internal glutamic acid” Zyklisierung eines 27 AS Peptids, das 21 hydrophobe Aminosäurereste enthält, wurde durchgeführt (theoretische molare Masse des offenkettigen Peptids : 2912) . 100 mg des Peptids mit einem Reinheitsgrad >95% wurde hergestellt und eine Probe davon mittels MALDI-TOF MS analysiert. Das MS zeigt den beim Ringschluß eingetretenen Verlust an H2O (-18 amu). Das Spektrum zeigt das erwünschte Produkt mit dem Molekülion bei m/z 2895.0.
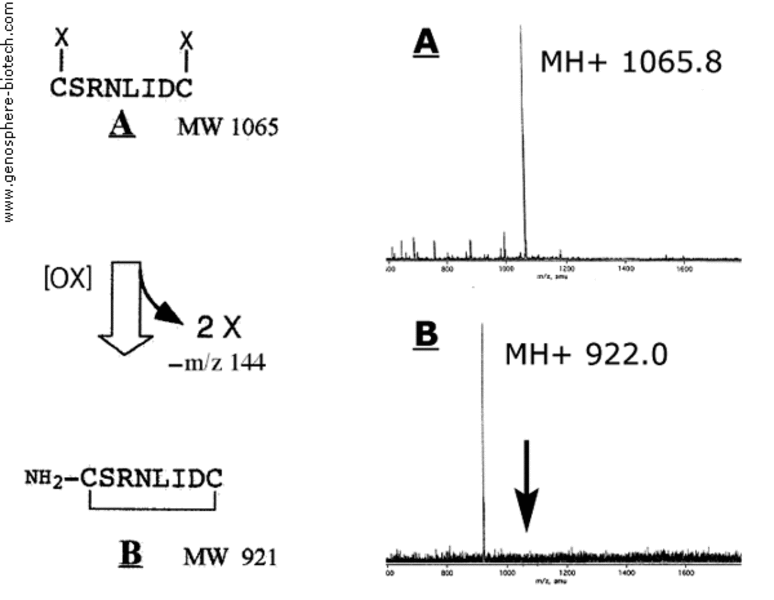
Massenspektren des “A” linear geschützen Vorläuferpeptids(+2X) und “B“ des final zyklisierten Peptids (-2X).
Labels und Spacers
In Abhängigkeit von Ihren Wünschen stellen wir für Sie biotinylierte oder fluoreszierende Peptide mit unterschiedlich langen Spacern her. Eine Auswahl von Spacern steht hierzu zur Verfügung : Aliphatische C3, C6, C12, C18 Spacer oder auch verschiedene hydrophile Polyethylenglykol- Spacer (PEG).
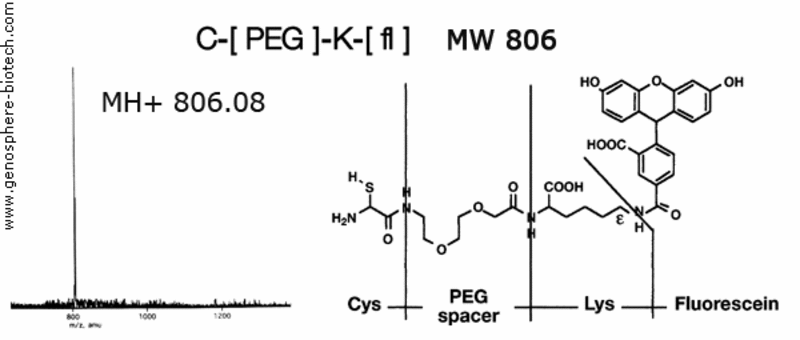
MS eines fluoreszierenden Peptids, das einen PEG Spacer enthält.
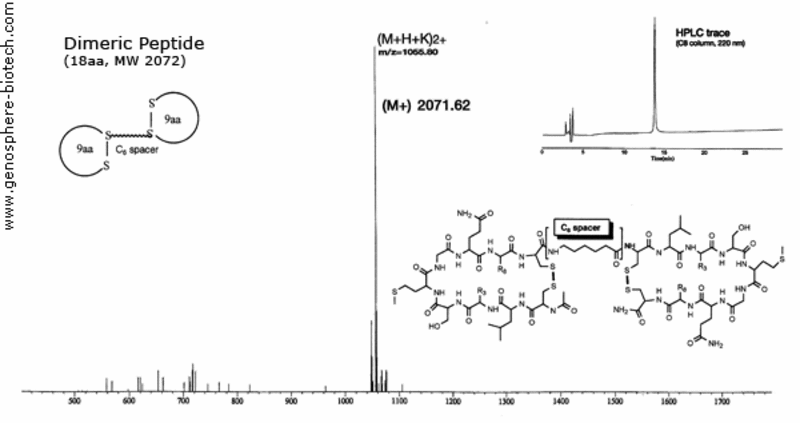
MS und HPLC Chromatogramm eines zyklischen Peptid-Dimers, das durch einen Aminohexansäure-(C6)-Spacer verbunden ist (theoretische molare Masse : 2072).
Peptid-Enden
Unsere Peptide werden normalerweise mit unblockierten, freien –NH2 und –COOH Termini synthetisiert.
In manchen Fällen jedoch, werden blockierte oder modifizierte Endgruppen gewünscht.
Peptide mit N-acetyl und C-amid Gruppen sind geringer (un)geladen und auch weniger löslich. Sie verhalten sich damit ähnlich wie Sequenzen innerhalb eines Proteins. Diese Eigenschaft wird häufig bei der Auswahl von Peptidepitopen für die Produktion von Antikörpern berücksichtigt. Außerdem verbessert die Blockierung der Endgruppen die Stabilität der Peptide gegenüber enzymatischen Abbaureaktionen.
| N-terminal | C-terminal |
| acetyl, formyl | amide |
| myristoyl, palmitoyl | hydroxyl |
| carboxyl | thioester |
| 2-furoyl | weitere Modifikationen auf Anfrage. |
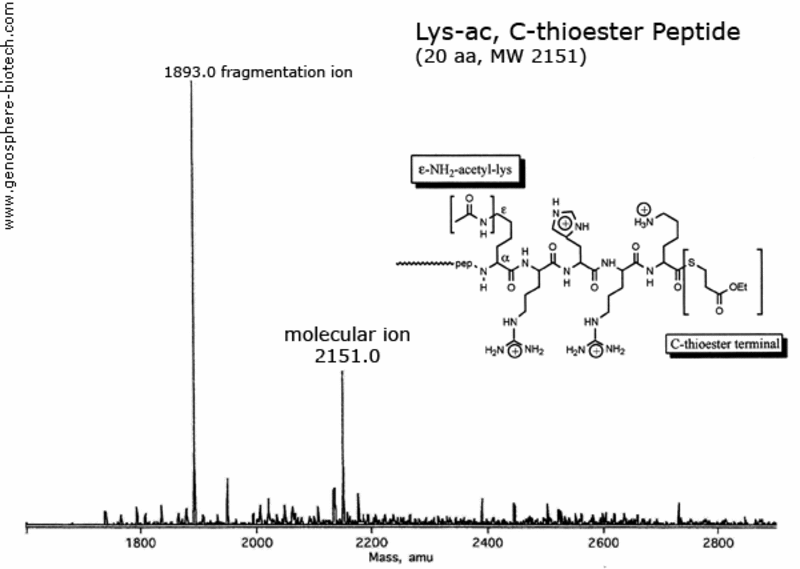
Massenspektrum eines 20 AS Peptids mit einem acetylierten Lysine und einem Thioesterblockiertem C-Terminus (theoretische molare Masse : 2151).
Viele Modifikationen verfügbar
Die untenstehenden zwei Tabellen zeigen einige der von uns angebotenen Peptidmodifikationen in der Übersicht.
Sollte die von Ihnen benötigte Modifikation hier nicht aufgeführt sein, dann fragen Sie uns bitte danach.
| "Unübliche" Aminosäuren | Chemische Modifikationen |
| D-form | Phosphorylierte AS:p-Tyr, p-Ser, p-Thr |
| Hydroxyprolin | Biotin, DNP |
| Pyroglutamin | C-terminales Anilid |
| Methyl-, Acetyl-Lysin | Benzyloxycarbonylation |
| 4-Bromo-, 4-Nitro-phe | Nitrosation |
| beta-Alanin | N-Methylation |
| Fluoreszenzmarkierungen | Makromolekulare Konjugation |
| Coumarin | Fettsäuren |
| Fluoreszein | Konjugation an Proteine, BSA, KLH, OVA |
| Rhodamin | Zyklisierung |
| DANSYL | cys-cys Disulfidbrücken |
| NBD | „Head-to-tail“ Zyklisierung |
| DABCYL | Lactame und Lactone |
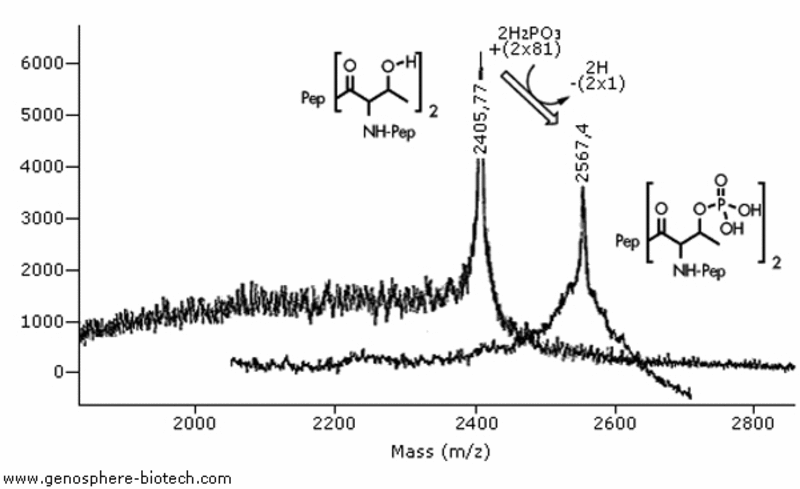
MALDI-TOF MS Analyse von zwei 20 AS Peptiden mit zwei Threoninen: (I) Peptid mit 2 unmodifizierten Threoninen, theoretische molare Masse 2404 und (II) dasselbe Peptid mit 2 phosphorylierten Threoninen; theoretische molare Masse 2564.
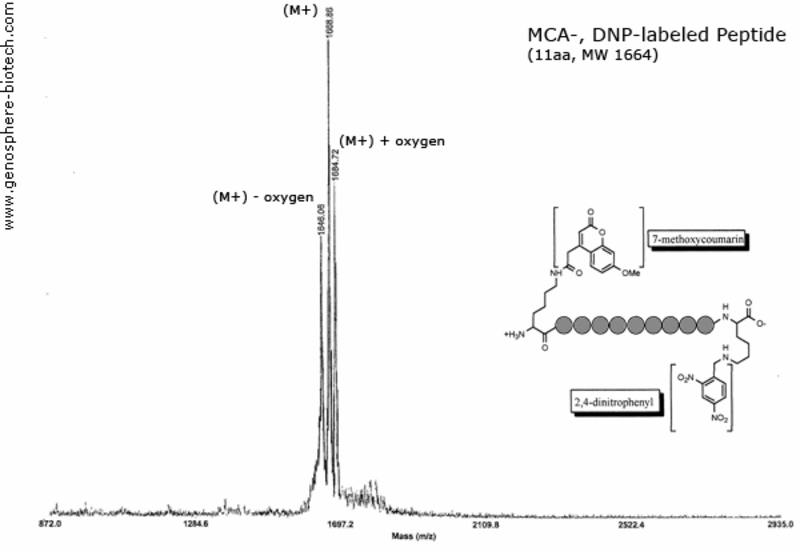
Massenspektrum eines dual gelabelten Peptids (11 AS, theoretische molare Masse 1664) : 7-methoxycoumarin (MCA) und 2,4-dinitrophenyl (DNP) verbunden durch die ε-Amin Gruppe des Lysins.

